의료기기 혁신해도…정부 심사만 490일
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
식약처-보건연구원 '이중 규제'
"모든 의료기기 선진입 후평가를"
"모든 의료기기 선진입 후평가를"
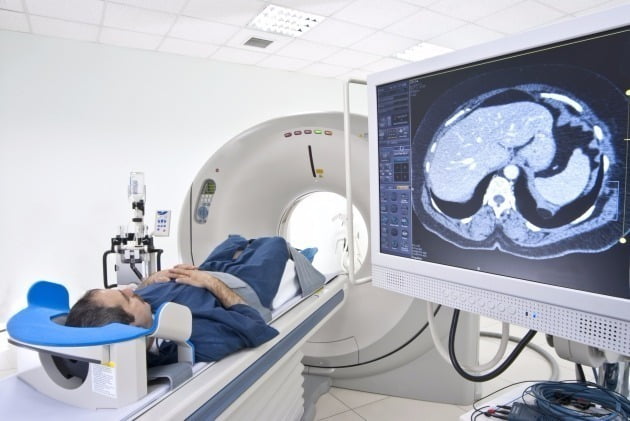
국내에서 사용한 적이 없거나 세계 최초로 개발된 의료기기는 식약처의 인허가 과정 외에도 ‘신의료기술평가’를 거쳐야 한다. 신의료기술평가란 새로운 의료기술이 국민에게 사용되기 전 안전하고 유효한지를 세밀하게 평가하는 제도로 2007년 도입됐다. 다만 도입과 동시에 이중 규제 논란이 불거졌다. 신의료기술평가 기간에는 시장 진입이 불가하기 때문이다. 이에 업계에서는 임상을 거쳐 유효성과 안전성을 인정받은 의료기기를 또 한 차례 평가해 시장 진입만 늦춰진다는 불만이 제기돼 왔다. 신의료기술평가까지 받게 되면 개발 기간을 제외한 인허가 기간만 최장 490일이 걸린다.
신의료기술평가를 통과하기도 어렵다. 지난해 국회입법조사처가 발간한 ‘2024년 국정감사 이슈 분석’에 따르면 2007~2016년 국내에서 신의료기술평가를 통과한 비율은 전체 신청 기관과 기업 가운데 23%에 불과하다. 신의료기술평가 절차를 경험한 국내 의료기기 업체 대표는 “식약처 허가를 받기 위해 낸 논문이 있는데도 보건의료연구원은 무작정 새로운 대규모 임상시험 결과를 가져오라고 하는 식”이라고 말했다. 정부의 모호한 평가 기준에 기업이 피해를 보는 사례도 있다. 루트로닉은 레이저로 ‘황반변성’을 치료할 수 있는 의료기기를 세계 최초로 개발했다. 그런데도 임상 근거가 부족하다는 이유로 신의료기술평가를 통과하지 못했다. 반면 미국 식품의약국(FDA)과 유럽에서는 판매 허가를 받았다. 이 과정에서 호주 업체에 세계 최초 타이틀을 뺏겼다.
정부는 이 같은 불만을 받아들여 ‘선(先) 진입, 후(後) 평가’ 방안을 지난해 11월 내놨다. 그러나 적용 대상은 인공지능(AI) 진단보조기기 등 일부 소프트웨어형 의료기기와 체외 진단기기 등에 그쳤다. 이영규 한국의료기기협동조합 이사장은 “모든 의료기기에 대한 선 진입 후 평가 제도 도입이 필요하다”고 했다.
오현아 기자 5hyun@hankyung.com
ADVERTISEMENT
ADVERTISEMENT


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


